Konfigurasi Relatif dan Konfigurasi Mutlak
Secara umum, kiralitas suatu objek paling nyata bila objek itu berinteraksi dengan objek kiral lainnya. Senyawa kiral itu sendiri berarti ketika karbon tertravalen mengikat empat gugus atau ligan yang berbeda. Kiral merupakan sifat ketanganan, dimana suatu objek disebut kiral jika tidak dapat ditumpangtindihkan dengan bayangan cerminnya.
Entatiomer memiliki sifat kiral yang identik, seperti titik lelelh, titik didih, rapatan, dan berbagai jenis spektrum. Kelarutannya dalam pelarut biasa yang akiral juga identik. Namun, entationer memiliki sifat kiral yang berbeda, salah satunya ialah arah pemutaran cahaya terpolarisasi-bidang (searah atau berlawanan arah jarum jam).
Meskipun entationer memutar cahaya terpolarisasi-bidang ke arah yang berlawanan, keduanya memiliki rotasi spesifik yang sama besarnya (tetapi dengan arah yang berlawanan), sebab besarnya derajat bukanlah sifat kiral. Hanya arah rotasi yang merupakan sifat kiral.
Konfigurasi Relatif (Ketentuan Fischer)
Konfigurasi Relatif merupakan konfigurasi yang membandingkan atom-atom dalam ruang tiga dimensi dalam suatu senyawa dengan yang lain. Dalam menggamabarkan sturktur proyeksi fischer harus memperhatikan beberpa aturan, antara lain : gugus-gugus yang diletakkan horizontal adalah gugus-gugus yang mendekati pengamat. Gugus-gugus yang diletakkan vertikal adalah gugus-gugus yang menjauhi pengamat. Hetero atom (atom selain C dan H) diletakkan diatas. Contoh molekul Fischer untuk molekul metana (CH4). Cara penggambaran metana dari bentuk 3 dimensi menjadi 2 dimensi ini didasarkan pada 4 point peraturan dalam menggambar proyeksi fischer.
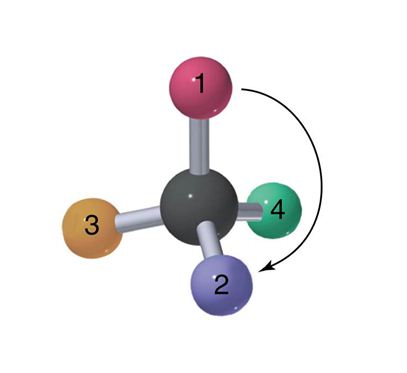
Pada gambar 3 dimensi atom H (hydrogen) nomor 1 dan 3 letaknya mendekati pengamat maka digambarkan dalam posisi horizontal. Dan H nomor 2 dan 4 menjauhi pengamat maka digambarkan dalam posisi vertikal. Pada bentuk 3 dimensi sebenarnya besar sudut antara molekul hydrogen adalah 109,5° sedangkan pada bentuk 2 dimensi biasanya menggambarkan sudut antar molekul hydrogen 90°.
Konfigurasi mutlak (Ketentuan Cahn-Ingold-Prelog)
Konfigurasi mutlak merupakan konfigurasi mutlak adalah konfigurasi yang penataan atom-atom dalam tiga dimensi dengan orientasi yang sudah pasti. Konfigurasi mutlak menggunakan arah orientasi R (rectus) dan S (sinister) untuk setiap pusat kiral dalma molekul dan merupakan pilihan untuk menentukan konfigurasi pusat kiral molekul obat . Penentuan pusat gugus yang melekat pada pusat kiral berdasarkan nomor atom yang bersangkutan. Arah orientasi R adalah searah jarum jam, sedangkan arah orientasi S adalah berlawanan jarum jam. Cara penentuan konfigurasi R dan S berdasarkan ketentuan Chan-Ingold-Prelog
- Urutkan prioritas keempat atom yang terikat pada pusat kiral berdasarkan nomor atomnya. Diketahui nomor atom Br = 35, Cl = 17, F = 9, H = 1, maka urutan prioritas keempat atom di atas adalah Br > Cl > F > H.
- Gambarkan proyeksi molekul sedemikian rupa hingga atom dengan prioritas terendah ada di belakang atau putar struktur (1) dan (2) sehingga atom H ada di belakang.
- Buat anak panah mulai dari atom/gugus berprioritas paling tinggi ke prioritas yang lebih rendah.
- Bila arah anak panah searah jarum jam, konfigurasinya adalah R. Bila arah anak panah berlawanan dengan arah jarum jam, konfigurasinya adalah S. Jadi konfigurasi struktur (1) adalah S, sedangkan konfigurasi struktur (2) adalah R.
Pemisahan Campuran resemik
Proses pemisahan campuran resemik menjadi entatiomernya dinamakan resolusi. Karena entatiomer memiliki sifat akiral yang identik, kita memisahkan dengan cara mengonversinya menjadi diastereomer, pisahkan diastereomer, dan kemudia merekonversi diastereomer yang sekarang telah terpisah menjadi enantiomernya kembali.
Untuk memisahkan dua enantiomer, pertama-tama kita reaksikan dengan reagen kiral. Produknya kan berupa sepasang diastereomer. Diastereomer ini diketahui berbeda dalam semua jenis dan sifatnya dan dapat dipisahkan melalui metode biasa. Sesudah diastereomer-diastereomer ini dipisahkan, kemmudian kita melaksanakan reaksi yang meregenerasi reagen kira itu dan memisahkan enantiomernya.







