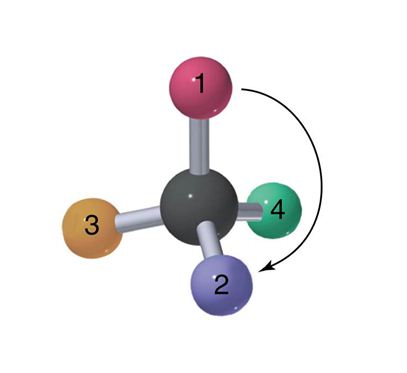
Hibridisasi orbital
Membahas mengenai orbital hibrida Nitrogen dan oksigen, selaknya kita perlu tahu apa yang dimaksud dengan hibridisasi. Hibridisasi adalah konsep pencampuran orbital atom menjadi orbital hibrida yang sesuia dengan pasangan elektron untuk membentuk ikatan kimia. Orbital hibrida biasanya mempunyai perbedaan energi dan bentuk. Hibridisasi berguna untuk menjelaskan struktur molekuler ketika teori ikatan valensi gagal untuk menjelaskan.
Beberapa tipe hibridisasi :

Yang akan kita bahas hanya tiga tipe yakni hibridisasi sp,sp2,dan sp3.
Hibridisasi sp
Hibridisasi sp dapat digunakan untuk menjelaskan molekul linier. Orbital 2s dan satu orbital 2p melakukan hibridisasi membentuk dua orbital sp, masing-masing terdiri dari 50% karakter p dan 50% karakter s. Misalnya alkuna yang mempunyai ikatan rangkap tiga.
Hibridisasi sp2
Hibridisasi sp2 digunakan untuk menjelaskan bentuk struktur molekul trigonal planar. Orbital 2s dan orbital 2p melakukan hibridisasi membentuk tiga orbital sp, masig-masing terdiri dari 67% karakter p dan 33% karakter s . Cuping depan mensejajarkan diri membentuk trigonal planar, menghadap sudut segitiga untuk meminimalisasi penolakan electron. Misalnya etilena (C2H4) yang memiiki iktan rangkap dua.
Hibridisasi sp3
Hibridisasi sp berguna untuk menjelaskan struktur tetrahedral, orbital 2s dan tiga orbital 2p melakukan hibridisasi untuk membentuk empat orbital sp. Masing-masing terdiri dari 75% karakter p dan 25% karakter s. cuping depan mnsejajarkan diri dan penolakan electron bersifat lemah. Contohya metana (CH4)
Ikatan rangkap terkonjugasi
Ikatan rangka terkonjugasi merupakan ikatan antar atom karbon atau yang terjadi pada senyawa organic yang secara kovale ikatan atar atomnya merupakan ikatan rangkap dua dan tunggal bergantian, dimana terjadinya delokalisasi electron agar tingakt energinya lebih stabil atau bias disebut dengan stabilisasi struktur.
Jika dibandingkan kestabilan ikatan C-C dengan ikatan C-O, ikatan antar atom C-O lebih kuat dan stabil dikarenakan jumlah elektron atom O yang di sumbangkan lebih banyak dari pada atom C yang hanya berjumlah 4 elektron yang mengakibatkan keelektronegatifan dan afinitas elektron iktan atom C-O lebih dibandingkan ikatan antar atom C-C.
Isomer geometri Cis dan Trans
Isomer geometri terbagi menjadi dua yakni Cis dan Trans. Bila subtituen terletak pada bidang yang sama maka disebut cis, sedangkan trans bila subtituen terletak pada bidang yang bersebrangan. Struktur trans lebih stabil dibandingkan dengan cis karena makin besar halangan sterik maka energinya makin besar inilah yang terjadi pada struktur cis.
Contohnya cis-2-butena dan trans-2-butena

Cis-2-butena lebih labil dibandingkan dengan trans-2-butena, sifat fisisnya pun berbeda, titik didih pada struktur trans ini lebih rendah dibandingkan dengan struktur cis karena kerapatan atau kebolehjadian menemukan elektron cis-2-butena yang lebih tinggi dibandingkan trans-2-butena. Sedangkan titik lebur cis-2-butena lebih rendah dari pada trans-2-butena, sehingga cis-2-butena lebih cepat melebur karena halangan steriknya lebih besar.
Benzena dan resonansi
Benzena termasuk senyawa aromatic yang merupakan senyawa siklik(rantai lingar) yang elektronya terkonjugasi. Jika satu atom H diambil atau dikurangi dari rumus molekul C6H6 akan menghasilkan suatu radikal fenil C6H5 yang disebut aril disingkat Ar. Benzena tidak dapat dibrominasi atau dilakukan pemutusan ikatan karena rantai sikliknya maka jika terjadi tanda-tanda pemutusan ikatan dapat distabilkan oleh ikatan pi (π) disebelahnya. Hal ini berhubungan dengan resonansi benzena.
Resonansi adalah delokalisasi elektron pada molekul atau ion poli atomic tertentu dimana ikatannya tidak dapat dituliskan dalam satu truktur Lewis. Struktur molekul atau ion yang mempunyai delokalisasi elektron disebut dengan struktur resonan. Dan ini telah menjelaskan bahwa mengapa benzene sulit untuk di lakukan pemutusan ikatannya.
Namun jika direaksikan dengan katalis asaw Lewis (acceptor proton) maka benzene dapat di brominasi. Adalah FeBr3 katalis dari teori asam Lewis yang dapat membantu Br masuk kedalam ikatan benzene . Hal ini dikarenakan Fe dapat menyerap elektron ikatan pada benzene. Subtittuen yang terdapat dalam rantai siklo benzene dapat digolongkan sebagai pengarah orto, para, dan meta.
Mekanisme Pengarah Orto, Para, Dan Meta
Benzena yang mulanya telah tersubtitusi dapat mengalami subtitsi kedua dan menghasilkan disubtitusi benzene. Dari struktur subtitusi pertama ini dapat menentukan tempat dari subtitusi keduanya. Misalkan saja, dalam TNT (trinitrotoluene) pada cincin benzena terdapat suatu gugus metil yang mengarahkan subtitusi ke wilayah orto atau para. Sedangkan gugus nitro dapat mengarahkan subtitusi ke wilayah meta. Semua pengarah orto dan para merupakan pendonor elektron, yang dapat terjadi Karen resonansi maupun induksi. Pengarah meta mempunyai atom bermuatan positif atau sebagian positif yang terikat pada cincin benzena.